Interview de Gwenola Le Dréan – 1ere partie

Bonjour,
Nous avons aujourd’hui le plaisir d’interviewer Gwenola Le Dréan, physiologiste et spécialiste de l’axe intestin-cerveau est chercheure à INRAE – l’Institut National de Recherche pour l’Agriculture, l’Alimentation et l’Environnement – au laboratoire UMR 1280 « Physiopathologie des Adaptations Nutritionnelles » qu’elle co-dirige, à Nantes.
Vos travaux de recherche visent à comprendre comment une nutrition périnatale déséquilibrée augmente le risque de maladies métaboliques et cognitives plus tard dans la vie. Vous étudiez ainsi entre autres la communication entre des cellules intestinales productrices d’hormones et les neurones sensoriels qui signalent au cerveau la présence des nutriments et des métabolites bactériens de la lumière intestinale.
Pouvez-vous tout d’abord nous parler du concept de l’origine développementale des maladies et de la santé ?
Le concept de l’origine développementale des maladies et de la santé, connu sous l’acronyme DOHaD (Developmental Origin of Health and Disease) a été énoncé pour la première fois dans les années 1990 par un médecin anglais : D.J. Barker. Il a mis en avant qu’un environnement nutritionnel altéré durant la période prénatale prédispose aux maladies cardio-métaboliques plus tard dans la vie, comme par exemple le diabète de type 2, l’hypertension ou encore l’obésité. Les études épidémiologiques de Barker sont basées sur un suivi d’individus dont les poids de naissance et à un an avaient été répertoriés dans la cohorte du Hertfordshire, ou encore ceux qui ont été exposés in utero à la famine lors du « Dutch Hunger Winter » en 1944. Ces études l’ont amené à concevoir que le métabolisme et la croissance d’un fœtus en situation de carence nutritionnelle s’adapte à cet environnement appauvri. Et cette adaptation métabolique induit un « phénotype économe » qui permet de protéger le développement des organes clefs comme le cerveau ou les reins, au détriment de la croissance.
Néanmoins, face à une abondance calorique telle que fréquemment rencontrée dans les régimes gras et sucrés occidentaux, ce phénotype ne parvient pas toujours à s’adapter et contribue à l’apparition de maladies métaboliques chroniques, telles que les troubles cardiovasculaires, métaboliques ou encore cognitifs plus tard dans la vie.
De façon intéressante, il a été montré depuis, qu’un environnement nutritionnel périnatal déséquilibré – qu’il soit en sous ou en surcharge de calories ou de nutriments essentiels, créent une possibilité similaire de développer ces maladies, et cela est dû à la grande plasticité des organes en développement.
Si cette fenêtre périnatale des 1000 premiers jours, qui va de la conception aux deux premières années de vie, est extrêmement sensible à l’environnement, il faut aussi dire qu’elle constitue également une opportunité de prévention et d’intervention pour corriger ou limiter les risques de maladies futures.
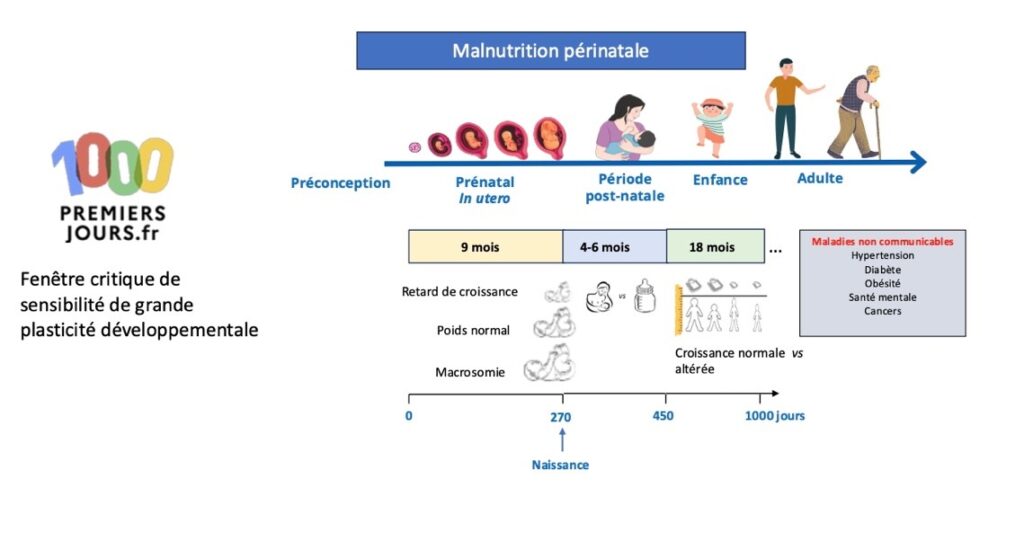
Le concept de la DOHaD illustré par les conséquences d’une malnutrition périnatale sur le risque de maladies chroniques plus tard dans la vie. Créée par BioRender et adaptée de Mayneris-Perxachs and Swann, 2019.
Merci. Et pour encore mieux comprendre ces enjeux, pouvez-vous nous expliquer quel est le rôle de la nutrition des 1000 premiers jours sur l’axe microbiote-intestin-cerveau ?
Effectivement, il est important de préciser que l’axe intestin-cerveau définit initialement la communication bidirectionnelle qui a lieu entre ces deux organes. Cette communication est connue et décrite depuis plusieurs décennies dans la régulation de la prise alimentaire. Au moment de l’arrivée des aliments, l’intestin envoie des signaux nutritionnels et digestifs – tels que la distension de l’estomac et de l’intestin grêle, la production d’hormones qui régulent la prise alimentaire … vers le tronc cérébral qui renvoie des signaux de régulation des fonctions digestives comme par exemple la motricité des muscles de la paroi intestinale – qui assure le transit du bol alimentaire. Toute cette communication est assurée via la circulation sanguine mais également via le nerf vague qui intègre les signaux mécaniques et hormonaux ainsi que ceux en provenance des systèmes nerveux et immunitaires du tube digestif. Ainsi, au-delà de la mise en place de la satiété ou l’état de non faim, régulée par voie réflexe grâce à cette communication, les signaux transmis par l’axe intestin-cerveau jouent un rôle central. Ce rôle est déterminant non seulement dans la régulation de la balance énergétique entre apports et dépenses caloriques, mais également dans des fonctions cognitives supérieures d’apprentissage, de mémorisation, et dans la perception de la douleur viscérale, du stress et de l’anxiété.
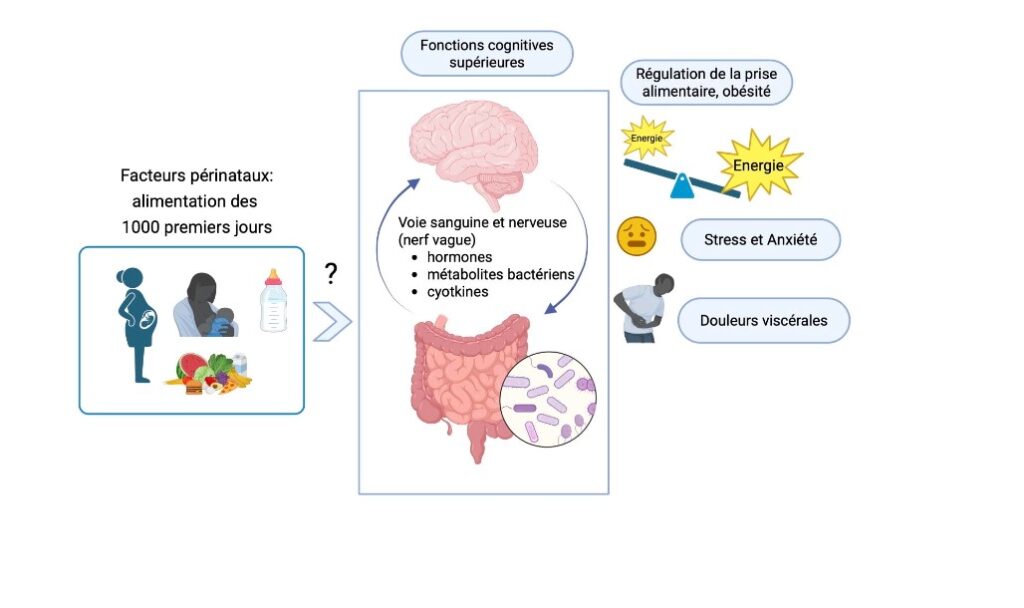
Quel rôle de la nutrition des 1000 premiers jours sur l’axe microbiote-intestin-cerveau et son implication dans certains troubles de santé future ? Créée par BioRender.
Pouvez-vous aussi préciser quelle est l’action du microbiote ?
De façon plus récente, un nouvel acteur s’est invité dans la connaissance que nous avions de cet axe : le microbiote et ses 10 000 milliards d’organismes qui sont majoritairement, mais pas exclusivement, des bactéries. Le terme de « flore commensale » était parfois utilisé pour définir ces microorganismes avec qui nous partageons nos nutriments. Cet écosystème microbien est à présent appelé « microbiome » par les spécialistes du domaine mais le terme microbiote reste très courant.
Nous hébergeons notre microbiote dans un espace de vie qui lui est propice, l’intestin, et nous le nourrissons. En retour, le microbiote utilise un certain nombre de molécules que notre tube digestif ne peut assimiler, produit des molécules importantes pour notre organisme, des vitamines par exemple, et participe au développement des intestins et du système immunitaire. Il permet aussi d’éviter des infections en produisant des agents anti-microbiens tout en occupant la place que pourrait prendre certains microorganismes pathogènes dans notre intestin. Enfin, le microbiote intestinal envoie aussi des messages à notre cerveau en produisant des molécules comme par exemple des hormones qui régulent l’appétit ou encore des neurotransmetteurs qui assurent la communication d’un neurone à l’autre.
Les modèles animaux élevés de façon stérile – c’est à dire sans microbiote – ou qui sont traités aux antibiotiques, restent essentiels pour comprendre le rôle du microbiote dans le développement du système immunitaire, du cerveau et des comportements. Il est aussi à prendre en compte qu’un dysfonctionnement de l’axe microbiote-intestin-cerveau est souvent rapporté dans la physiopathologie de nombreuses maladies : maladies mentales, maladies neurodégénératives, obésité, maladies inflammatoires intestinales, etc…
Cet axe représente donc une cible de choix pour développer des nouvelles approches thérapeutiques ! Bien sûr, les recherches expérimentales doivent néanmoins être transposables à l’homme. C’est pourquoi des recherches translationnelles visant à démontrer le rôle causal du microbiote dans ces troubles sont en cours.
Et pourquoi les 1000 premiers jours sont-ils si déterminants dans la fonction du microbiote ?
Les 1000 premiers jours sont véritablement des fenêtres temporelles critiques du développement. C’est pendant ces 1000 premiers jours que le microbiome intestinal, et les métabolites qu’il produit, interagissent avec le système immunitaire et le système nerveux central du petit. Les métabolites bactériens produits par le microbiote maternel peuvent agir sur le neurodéveloppement en période fœtale via le placenta, comme c’est le cas avec les nutriments. Cependant, le neurodéveloppement du bébé poursuit son développement en période post-natale alors que s’effectue la colonisation du tube digestif par le microbiote. Le nouveau-né naît stérile. Au moment de l’accouchement, il rencontre le microbiote vaginal et fécal de sa mère s’il naît par voie basse, ou s’il naît par césarienne le microbiote cutané et celui de la salle d’accouchement ! Ce microbiote néonatal s’installe alors tel un pionnier sur un territoire vierge, prolifère et colonise le tube digestif. Cette colonisation se complexifie selon l’alimentation et l’environnement de l’enfant jusqu’à ses 2 ans, pour atteindre une composition relativement stable – quoique toujours discutée – autour de 4-6 ans.
Nous savons que l’alimentation est un facteur majeur de variation de la composition du microbiote chez l’adulte. Il est donc tout à fait concevable qu’un microbiote maternel modifié par une alimentation déséquilibrée, transmis au moment de la naissance, puisse affecter la santé future du bébé. Dans un modèle avec des rongeurs, nous avons pu mettre en évidence au laboratoire que les « inocula » préparés à partir des microbiotes de mères obèses ou de mères minces, distribués aux petits dès la naissance et pendant les jours qui suivent, avaient des effets différents sur le comportement alimentaire tout au long de leur vie. Ces « inocula » sont les microbiotes vaginaux, fécaux et issus du lait. Il apparait que les ratons ayant reçu un microbiote issu de mères obèses présentaient des altérations de leur comportement alimentaire qui tendait vers l’hyperphagie. De façon intéressante, dans ce modèle, la composition du microbiote transmis à la naissance ne perdurait pas dans le temps. Il a certainement contribué à l’assemblage du microbiome définitif mais ce n’est pas le microbiome adulte qui expliquait les différences de comportements alimentaires observées. Ainsi, il s’avère que c’est bien le microbiote reçu à la naissance qui était à l’origine des différences et nous pouvons donc envisager que ce microbiote néonatal a eu des effets sur le neurodéveloppement en début de vie, avec des conséquences sur le comportement alimentaire à l’âge adulte. D’autres études de transfert de microbiote standard de souris conventionnelles à des souris élevées sans microbiote intestinal – des souris axéniques- ont montré les effets plus importants du microbiote reçu au jeune âge plutôt qu’à l’âge adulte sur les comportements exploratoires et de réponse au stress.
La fenêtre post-natale est donc une période cruciale pour l’assemblage et la construction du microbiome intestinal du bébé. Il recevra le microbiote de sa mère tel que ce dernier a été lui-même formaté par la nutrition maternelle, incluant ses habitudes et ses comportements alimentaires.
Fin de la première partie de cet interview.
L’interview de Gwénola Le Dréan a été réalisé sur la base de son article publié en 2025 dans le numéro 84 de la revue « A3 Magazine », en accord avec la rédaction d’A3 Magazine.


